MINI ARVOSTELU
Syövän etuvartio: universaalit vain syövän merkkiaineet
Chengchen Qian1, Xiaolong Zou2, Wei Li1,3, Yinshan Li4, Wenqiang Yu5
1Shanghai Epiprobe Biotechnology Co., Ltd, Shanghai 200233, Kiina;2 Yleiskirurgian osasto, Harbinin lääketieteellisen yliopiston ensimmäinen osasairaala, Harbin 150001, Kiina;3Shandong Epiprobe Medical Laboratory Co., Ltd, Heze 274108, Kiina;4 Ningxia Huin autonomisen alueen kansansairaala, Ningxian lääketieteellinen yliopisto, Yinchuan 750002, Kiina;5Shanghai Public Health Clinical Center & Department of General Surgery, Huashan Hospital & Cancer Metastasis Institute & Laboratory of RNA Epigenetics, Institutes of Biomedical Sciences, Shanghai Medical College, Fudan University, Shanghai 200032, Kiina
ABSTRAKTI
Syöpä on johtava kuolinsyy maailmanlaajuisesti.Syövän varhainen havaitseminen voi alentaa kuolleisuutta kaikkiin syöpiin;tehokkaita varhaisen havaitsemisen biomarkkereita kuitenkin puuttuu useimmista syöpityypeistä.DNA:n metylaatio on aina ollut kiinnostava kohde, koska DNA:n metylaatio tapahtuu yleensä ennen muita havaittavissa olevia geneettisiä muutoksia.Tutkittaessa syövän yhteisiä piirteitä käyttämällä uutta opastettua paikannussekvensointia DNA-metylaatiolle, sarja universaaleja vain syöpää osoittavia markkereita (UCOM) on noussut vahvoiksi ehdokkaiksi syövän tehokkaaseen ja tarkkaan varhaiseen havaitsemiseen.Vaikka nykyisten syövän biomarkkerien kliinistä arvoa heikentää alhainen herkkyys ja/tai alhainen spesifisyys, UCOM:iden ainutlaatuiset ominaisuudet takaavat kliinisesti merkitykselliset tulokset.UCOM:iden kliinisen potentiaalin validointi keuhko-, kohdunkaulan-, endometriumin ja uroteelisyövissä tukee edelleen UCOM:ien käyttöä useissa syöpätyypeissä ja erilaisissa kliinisissä skenaarioissa.Itse asiassa UCOM-sovellusten sovelluksia tutkitaan parhaillaan aktiivisesti syövän varhaisessa havaitsemisessa, apudiagnoosissa, hoidon tehokkuudessa ja uusiutumisen seurannassa.Molekulaariset mekanismit, joilla UCOM:t havaitsevat syöpiä, ovat seuraavat tärkeät tutkittavat aiheet.UCOM:ien soveltaminen todellisissa skenaarioissa vaatii myös toteutusta ja tarkentamista.
AVAINSANAT
Syövän havaitseminen;syövän seulonta;DNA:n metylaatio;syövän epigenetiikka;syövän biomarkkerit
Miksi tarvitsemme kiireellisesti uutta biomarkkerit?
Yli vuosisadan ajan syöpää vastaan taisteltuaan syöpä on edelleen tappavin biologinen uhka ihmiskunnalle.Syöpä on edelleen maailmanlaajuinen terveysongelma, sillä vuonna 2020 arviolta 19,3 miljoonaa uutta tapausta ja lähes 10 miljoonaa kuolemantapausta1. Vuonna 2020 Kiinassa diagnosoitiin arviolta 4,6 miljoonaa uutta syöpätapausta, mikä vastaa 23,7 prosenttia uusista syöpätapauksista maailmanlaajuisesti GLOBOCAN1:n mukaan.Lisäksi Kiinassa vuonna 2020 noin 3 miljoonaa kuolemantapausta johtui syövästä, mikä oli 30 prosenttia maailmanlaajuisista syöpäkuolemista1.Nämä tilastot osoittivat, että Kiina on ensimmäisellä sijalla syövän ilmaantuvuuden ja kuolleisuuden suhteen.Lisäksi 5 vuoden eloonjäämisprosentti syövästä on 40,5 %, mikä on 1,5 kertaa pienempi kuin Yhdysvaltojen viiden vuoden eloonjäämisaste2,3.Suhteellisen alhaisempi eloonjääminen ja korkeampi kuolleisuus Kiinassa kuin maissa, joissa inhimillisen kehityksen indeksit ovat korkeammat, viittaavat siihen, että tehokas ja kustannustehokas syövän ehkäisy- ja seurantajärjestelmä tarvitaan kiireesti.Syövän varhainen havaitseminen on yksi terveydenhuoltojärjestelmän kriittisimmistä tekijöistä.Syövän varhainen havaitseminen voi parantaa ennustetta ja eloonjäämistä varhaisessa vaiheessa lähes kaikissa syöpätyypeissä4.Onnistuneet seulontastrategiat ovat johtaneet kohdunkaulan-, rinta-, paksusuolen- ja eturauhassyöpien ilmaantuvuuden ja kuolleisuuden merkittävään laskuun.
Syövän varhainen havaitseminen ei kuitenkaan ole helppoa.Varhaisen syövän biologian ja ennusteen tutkiminen, luotettavien varhaisen havaitsemisen biomarkkerien tunnistaminen ja validointi sekä saatavilla olevien ja tarkkojen varhaisen havaitsemisen tekniikoiden kehittäminen ovat aina olleet prosessin suurimmat esteet4.Syövän tarkka havaitseminen voi erottaa hyvänlaatuiset leesiot pahanlaatuisista, mikä auttaa välttämään tarpeettomia toimenpiteitä ja helpottaa taudin hallintaa.Nykyisiä varhaisen havaitsemisen strategioita ovat endoskooppipohjaiset biopsiat, lääketieteellinen kuvantaminen, sytologia, immunomääritykset ja biomarkkeritestit5-7.Koska endoskooppipohjaiset biopsiat ovat häiritseviä ja kalliita, ne ovat luonnostaan raskas taakka suurena lääketieteellisenä toimenpiteenä, joka perustuu ammattitaitoiseen henkilöstöön.Kuten sytologia, molemmat seulontamenetelmät riippuvat lääketieteen ammattilaisista ja perustuvat henkilökohtaiseen harkintaan, jonka suorituskyky on kaukana ihanteellisesta8.Sitä vastoin immunomääritykset ovat erittäin epätarkkoja, koska vääriä positiivisia tuloksia on korkea.Lääketieteellinen kuvantaminen seulontataktiikkana vaatii kalliita laitteita ja erikoistuneita teknikoita.Tästä syystä lääketieteellinen kuvantaminen on erittäin rajoitettua heikon saavutettavuuden vuoksi.Kaikista näistä syistä biomarkkerit näyttävät olevan parempi vaihtoehto syövän varhaisessa havaitsemisessa.
Kirjeenvaihto: Yinshan Li ja Wenqiang Yu
Email: liyinshan@nxrmyy.com and wenqiangyu@fudan.edu.cn
ORCID-tunnus: https://orcid.org/0009-0005-3340-6802 ja
https://orcid.org/0000-0001-9920-1133
Vastaanotettu 22. elokuuta 2023;hyväksytty 12. lokakuuta 2023;
julkaistu verkossa 28.11.2023.
Saatavilla osoitteessa www.cancerbiomed.org
©2023 Syöpäbiologia ja lääketiede.Creative Commons
Nimeä-ei-kaupallinen 4.0 kansainvälinen lisenssi
Biomarkkerit luokitellaan tällä hetkellä proteiineihin, DNA-mutaatiomarkkereihin, epigeneettisiin markkereihin, kromosomipoikkeavuuksiin, suoraan kasvaimista peräisin oleviin RNA-markkereihin tai epäsuorasti ruumiinnesteistä saatuihin kasvainfragmentteihin.Proteiinimarkkerit ovat yleisimmin käytettyjä biomarkkereita syövän seulonnassa ja diagnosoinnissa.Proteiinin biomarkkereita seulontabiomarkkereina rajoittaa taipumus vaikuttaa hyvänlaatuisiin leesioihin, mikä johtaa ylidiagnosointiin ja ylihoitoon, kuten on raportoitu α-fetoproteiinin ja eturauhasspesifisen antigeenin (PSA) kohdalla9,10.RNA-markkerit sisältävät geneettisiä ilmentymismalleja ja muita ei-koodaavia RNA-markkereita. Geneettisen ilmentymisen yhdistelmä RNA-markkereita voidaan havaita käyttämällä virtsanäytteitä, joiden herkkyys oli kaukana tyydyttävästä (60 %) primaarikasvainten osalta ja jonka havaitseminen voi RNA:n helposti hajoava luonne normaaliympäristössä vaikuttaa siihen11.Geneettiset ja epigeneettiset markkerit kohtaavat sekä kasvainten esiintyvyyden että syöpätyyppien rajoittamisen ongelman.
DNA-metylaatio on ollut vahva ehdokas varhaisen havaitsemisen biomarkkerina siitä lähtien, kun Feinberg yhdisti sen ensimmäisen kerran syöpään vuonna 198312. DNA-metylaatiopoikkeavuuksia havaitaan syövän kaikissa vaiheissa, jo syövän esiasteessa.Poikkeava DNA:n hypermetylaatio tapahtuu yleensä CpG-saarilla geenipromoottoreissa tuumorisuppressoreita vastaan13,14.Tutkimukset ovat myös ehdottaneet, että epänormaali DNA:n hypermetylaatio osallistuu kehityksen säätelijöiden lisääntymiseen15.DNA-metylaatiolaakso, joka liittyy yleisesti kehityksen säätelijöihin ja hypermetyloituneisiin syöpiin, saattaa vaihtaa geenin ilmentymistilan vakaampaan DNA-metylaatiosta riippuvaiseen tilaan ja vähentää yhteyttä metyloituun histoniin H3K27me3 ja siihen liittyviin polykombiproteiineihin16,17.
Useiden julkaistujen DNA-metylaatiomarkkereiden joukossa useat ovat onnistuneesti debytoineet markkinoilla;Nykyiset kaupalliset DNA-metylaatiomarkkerit ja diagnostiset paneelit eivät kuitenkaan ole vielä täysin vapauttaneet syövän varhaisen havaitsemisen mahdollisuuksia useista syistä18.Vaikka nämä biomarkkerit osoittavat enimmäkseen hyväksyttävää suorituskykyä tietokantatietojen avulla, ne toimivat yleensä vähemmän ihanteellisesti todellisessa maailmassa, koska todelliset näytteet ovat usein monimutkaisempia eivätkä niin edustavia kuin tietokantoihin valitut.Seuraavan sukupolven sekvensointiin perustuvalla usean syövän metylaatiolla varhaisessa havaitsemisessa on osoitettu olevan vain 16,8 % ja 40,4 % herkkyys vaiheen I syövissä19.Varhaisen havaitsemisen testit edellyttävät suurempaa vakautta ja tarkempia biomarkkereita.
Universaalin vain syöpämarkkerin (UCOM) löytö käyttämällä opaspaikannussekvenssiä (GPS)
Vuosikymmenten syöpätutkimuksesta huolimatta tyydyttävää ehkäisyä ja hoitoa ei ole saavutettu.Tarvitaan uusia menetelmiä, jotta tutkijat voivat arvioida syöpää perusteellisesti.Viimeisten 23 vuoden aikana 6 syövän tunnusmerkkiä, kuten apoptoosin välttäminen, kudosinvaasiot ja metastaasit jne., on laajennettu 14:ksi sisällyttämällä ominaisuuksia, kuten ei-mutaatioon perustuva epigeneettinen uudelleenohjelmointi ja polymorfiset mikrobiomit20,21.Mitä enemmän syöpään liittyviä yksityiskohtia paljastetaan, sitä enemmän näkökulmia syöpätutkimukseen tuodaan.Syöpätutkimus on vähitellen tullut uudempaan aikakauteen kahdessa suunnassa (yhteisyydessä ja yksilöllisyydessä).Tarkkuusonkologian kehityksen myötä viime vuosina syöpätutkimuksen painopiste on kallistumassa yksilölliseen kohdennetun terapiaan ja syövän heterogeenisyyteen22.Siten äskettäin tunnistetut syövän biomarkkerit ovat keskittyneet pääasiassa tiettyihin syöpätyyppeihin, kuten PAX6 kohdunkaulan syöpään23 ja BMP3 paksusuolensyöpään24.Näiden syöpätyypeille spesifisten biomarkkereiden tehokkuus vaihtelee, mutta herkillä yksilöillä ei silti ole mahdollista seuloa kaikkia syöpiä samanaikaisesti biologisten näytteenottorajoitusten ja korkeiden kustannusten vuoksi.Olisi ihanteellista, jos pystyisimme tunnistamaan yhden, vankan biomarkkerin, joka on tehokas kaikentyyppisiin syöpiin varhaisessa vaiheessa.
Tällaisen ihanteellisen tavoitteen saavuttamiseksi parempi biomarkkeriehdokas on valittava mahdollisten biomarkkerityyppien luettelosta.DNA:n metylaatiopoikkeamien kaikkien geneettisten ja epigeneettisten profiilien joukossa tiedetään liittyvän syöpään, ja ne ovat aikaisimpia, ellei ensimmäisiä, syöpään liittyviä poikkeavuuksia, jotka esiintyvät kronologisesti.DNA:n metylaation tutkiminen aloitettiin varhain, mutta sitä on jarruttanut tutkimusmenetelmien puute.Genomin 28 miljoonan potentiaalisen metyloidun CpG-kohdan joukosta on havaittava hallittavissa oleva määrä ja kohdistettava se genomiin, jotta tuumorigeneesi voidaan ymmärtää paremmin.Koko genomin bisulfiittisekvensointi (WGBS), jota pidetään DNA-metylaatiosekvensoinnin kultastandardina, voi kattaa vain 50 % Cs:stä syöpäsoluissa johtuen bisulfiittikäsittelyn luonteesta, joka rikkoo DNA-fragmentteja ja alentaa genomin monimutkaisuutta aikana. Cs-muunnos Ts25:ksi.Muut menetelmät, kuten 450 000 sirut, kattavat vain 1,6 % genomin metylaatiosta.450 000 datan perusteella DNA-metylaation havaitsemispaneelin herkkyys on 35,4 % kuudelle vaiheen I syövälle26.Syöpätyyppien rajoitukset, huono suorituskyky ja havaitsemismenetelmien aiheuttama melu analyyttisessä prosessissa ovat nousseet suurimmaksi esteeksi yleissyövän havaitsemispaneeleille.
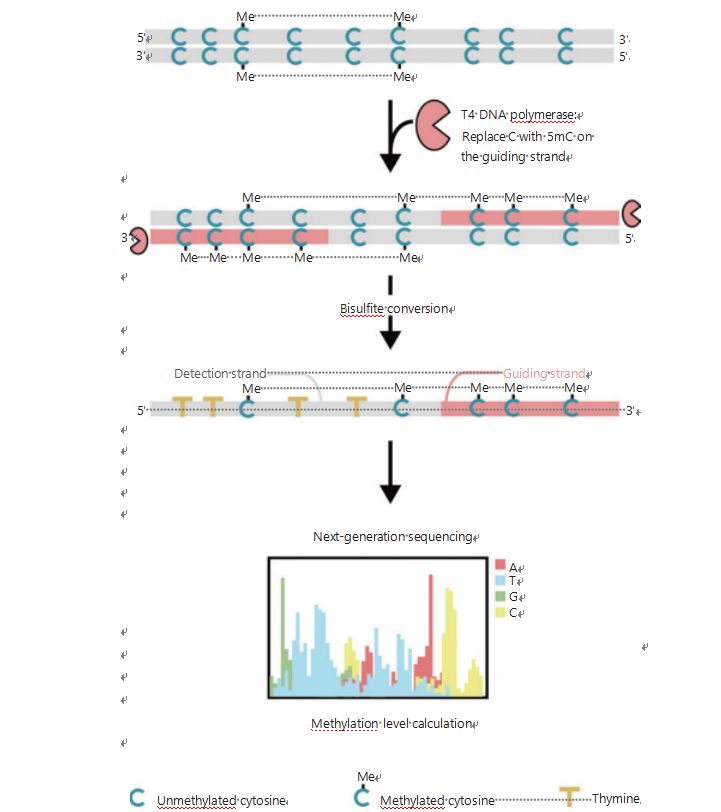
Jotta voitaisiin paremmin tutkia solujen epigeneettisiä malleja tuumorigeneesin ja etäpesäkkeiden aikana, kehitimme ainutlaatuisen GPS:n genominlaajuiseen DNA-metylaation havaitsemiseen, joka kattaa jopa 96 % CpG-kohdista 0,4 miljardilla lukemalla25.GPS on kaksipuolinen sekvensointimenetelmä, jossa käytetään ei-konvertoituvien metyylisytosiinien DNA-fragmentin 3'-päätä bisulfiittikäsittelyn jälkeen ja joka ohjaa 5'-pään DNA-metylaatiolaskelman kohdistusta paripään sekvensoinnin kautta (kuva 1)25.Metyyli-sytosiinia ohjaava juoste, joka toimii templaattijuosteena, auttaa korkean GC-alueen kohdistuksessa, mikä palauttaa perinteisen WGBS:n hylätyimmät sekvensointitiedot.GPS:n korkea peitto-ominaisuus tarjoaa valtavan määrän DNA-metylaatiotietoa, jonka avulla voimme tutkia syövän metylaatioprofiileja huomattavasti korkeammalla resoluutiolla aiemmin alitutkituilla alueilla.
GPS tarjoaa meille tehokkaan työkalun syövän homogeenisuuden tutkimiseen, mikä voi yksinkertaistaa huomattavasti syöpätutkimusta ja mahdollisesti löytää yleisen selityksen tuumorin syntymiselle ja etäpesäkkeille.Analysoitaessa syöpäsolulinjojen GPS-tietoja havaittiin usein ainutlaatuinen ilmiö.Monissa syöpänäytteissä oli useita alueita, jotka näyttivät olevan epänormaalisti hypermetyloituneita.Tämä odottamaton havainto validoitiin myöhemmin toimimaan UCOM:ina.Yli 7 000 näytettä 17 syöpätyypistä The Cancer Genome Atlas (TCGA) -tietokannassa on analysoitu, joista tunnistettiin ensimmäinen UCOM, HIST1H4F, histoniin liittyvä geeni, joka hypermetyloituu kaikissa syövissä27.Sitten TCGA-tietokannasta, Gene Expression Omnibus (GEO) -tietokannasta ja todellisista kliinisistä näytteistä löydettiin ja validoitiin joukko UCOM:ita.Tähän mennessä HIST1H4F, PCDHGB7 ja SIX6 on löydetty ja vahvistettu UCOM:iksi.UCOM:ien odottamaton löytö tarjoaa tehokkaan vastauksen syövän varhaisen havaitsemisen tarpeeseen.UCOM:t tarjoavat ratkaisun useiden syöpien yhden markkerin havaitsemiseen.
UCOM:ien ominaisuudet
Validoinnin jälkeen UCOM:illa on osoitettu olevan neljä pääominaisuutta, joiden avulla UCOM:t voivat ylittää nykyisten biomarkkerien tehokkuuden (kuva 2).
Ainutlaatuinen pahanlaatuisille kasvaimille
UCOM:t ovat ainutlaatuisia syöpä- tai syöpää edeltäville vaurioille, eivätkä normaalit fysiologiset muutokset vaikuta niihin.Jotkut nykyisistä syöpään liittyvistä markkereista, joita on laajalti käytetty varhaisessa havaitsemisessa ja/tai seulonnassa, ovat johtaneet ylidiagnosointiin.Kohonneita PSA-tasoja, jotka ovat kliinisesti akkreditoitu seulontatyökalu, havaitaan myös hyvänlaatuisissa tiloissa, kuten eturauhasen liikakasvussa ja eturauhastulehduksessa10.Ylidiagnoosi ja siitä johtuva ylihoito heikentävät elämänlaatua suolisto-, virtsatie- ja seksuaalisten komplikaatioiden vuoksi28.Muut proteiinipohjaiset ja laajalti kliinisessä ympäristössä käytetyt biomarkkerit, kuten CA-125, eivät ole tuottaneet merkittäviä etuja, kun ne ovat aiheuttaneet ylidiagnoosia ja ylihoitoa29.UCOM:iden korkea spesifisyys pahanlaatuisille kasvaimille välttää nämä puutteet.UCOM, PCDHGB7, erottaa tehokkaasti korkea-asteiset levyepiteliaaliset vauriot (HSIL) ja kohdunkaulan syövän normaaleista näytteistä ja matala-asteisista levyepiteliaalisista vaurioista (LSIL), kun taas useimmat muut biomarkkerit voivat erottaa vain kohdunkaulan syövän normaaleista näytteistä30.Vaikka PCDHGB7 ei havaitse merkittäviä eroja normaalin endometriumin ja kohdun limakalvon liikakasvun välillä, merkittäviä eroja havaitaan normaalin kohdun limakalvon ja epätyypillisen liikakasvun välillä, ja vielä suurempia eroja havaitaan normaalin kohdun limakalvon ja kohdun limakalvon syövän (EC) välillä PCDHGB731:n perusteella.UCOM:t ovat ainutlaatuisia tietokantoissa ja kliinisissä näytteissä oleville pahanlaatuisille vaurioille.Potilaan näkökulmasta ainutlaatuiset UCOM:t vähentävät kynnystä ymmärtää monimutkaisia merkkejä erilaisista huonosti toimivista epävakaista biomarkkereista ja vastaavaa ahdistusta arviointiprosessin aikana.Kliinikon näkökulmasta ainutlaatuiset UCOM:t erottavat pahanlaatuiset kasvaimet hyvänlaatuisista leesioista, mikä helpottaa potilaiden luokittelua ja vähentää tarpeettomia lääketieteellisiä toimenpiteitä ja ylihoitoa.Siksi ainutlaatuiset UCOM:t vähentävät lääketieteellisten järjestelmien redundanssia, lievittävät järjestelmän häiriötä ja tarjoavat enemmän lääketieteellisiä resursseja sitä tarvitseville.
Kuva 1 Kaavio GPS-työnkulusta DNA-metylaation havaitsemiseen25.Harmaa viiva: syötetty DNA-sekvenssi;punainen viiva: DNA, joka on käsitelty T4-DNA-polymeraasilla, joka korvaa sytosiinin 5'-metyylisytosiinilla syötteen 3'-päässä;sininen C Me:n kanssa: metyloitu sytosiini;sininen C: metyloitumaton sytosiini;keltainen T: tymiini25.
Kaikki tai ei mitään
UCOM-soluja on vain syöpäsoluissa, ja niitä havaitaan vakaasti lähes kaikissa syöpäsoluissa.HIST1H4F validoitiin hypermetyloituvaksi lähes kaikissa kasvaintyypeissä, mutta ei normaaleissa näytteissä27.Samoin PCDHGB7:n ja SIX6:n on myös osoitettu hypermetyloituneen kaikissa kasvainnäytteissä, mutta ei normaaleissa näytteissä30-32.Tämä ainutlaatuinen ominaisuus parantaa merkittävästi UCOM:iden suorituskykyä havaitsemis- ja herkkyysrajojen suhteen.Vain 2 % syöpäsoluista voidaan erottaa näytteissä, mikä tekee UCOM:ista paljon herkemmän biomarkkerin kuin useimmat olemassa olevat biomarkkerit30. Kolorektaalisyövän havaitsemiseen käytettynä biomarkkerina KRAS-mutaatioita esiintyy vain noin 36 %:ssa paksusuolen syöpätapauksista. viittaa huonoon diagnostiseen potentiaaliin33.KRAS-mutaatioiden alhainen esiintyvyys paksusuolensyövässä rajoittaa KRAS:n käyttöä yhdessä muiden biomarkkerien kanssa.Itse asiassa biomarkkerien yhdistelmä saattaa aluksi vaikuttaa lupaavalta, mutta se ei aina tuota tyydyttävää tulosta, vaikka se osoittaa paljon suurempaa kohinaa havaitsemisanalyysissä ja sisältää yleensä monimutkaisempia kokeellisia menettelyjä.Sitä vastoin PCDHGB7 ja muut UCOM: t esiintyvät kaikissa syövissä.UCOM:t havaitsevat syöpäkomponentit erityyppisistä syöpänäytteistä äärimmäisen tarkasti ja poistavat samalla monimutkaiset melua vaimentavat analyysiprosessit.Syövän havaitseminen runsaasta näytteestä ei ole vaikeaa, mutta syövän havaitseminen pienestä näytteestä on erittäin haastavaa.UCOM:t pystyvät havaitsemaan pieniä määriä syöpää.
Kuva 2 UCOM:ien ominaisuudet.
Syövän havaitseminen ennen patologisia muutoksia
UCOM:t voidaan havaita syöpää edeltävässä vaiheessa ennen patologisia muutoksia.Epigeneettisinä biomarkkereina UCOM-poikkeavuudet ilmenevät aikaisemmassa vaiheessa kuin fenotyyppiset poikkeavuudet, ja ne ovat havaittavissa koko tuumorigeneesin, etenemisen ja etäpesäkkeiden muodostumisen ajan34, 35.UCOM:n herkkyys ajan myötä parantaa UCOM:n suorituskykyä varhaisen vaiheen syövän ja syöpää edeltävien leesioiden havaitsemisessa.Varhaisen syövän havaitseminen biopsioiden ja sytologian perusteella voi olla vaikeaa kokeneemmillekin patologille.Yksi kolposkopialla otettu biopsia on raportoitu positiiviseksi 60,6 %:ssa HSIL+-näytteistä.Useita vaurioita varten tarvitaan lisää biopsioita herkkyyden lisäämiseksi36.Sitä vastoin UCOM:n PCDHGB7:n herkkyys HSIL+-näytteille on 82 %, mikä ylittää biopsioiden ja useimpien biomarkkerien herkkyyden30.Metylaatiomarkkerin FAM19A4 herkkyys CIN2+:lle on 69 %, mikä on samanlainen kuin sytologia, mutta ei voi erottaa CIN1:tä normaaleista näytteistä37.UCOM:iden on osoitettu olevan paljon herkempi varhaisen havaitsemisen biomarkkeri.Kokemukseen perustuviin patologiin verrattuna UCOM:illa on ylivoimainen havaitsemisherkkyys varhaisvaiheen syöpien suhteen, mikä puolestaan parantaa syövän ennustetta ja eloonjäämistä30.Lisäksi UCOM:t tarjoavat havaitsemisalustan, joka on käytettävissä alueilla, joilla ei ole kokeneita patologia ja joka parantaa huomattavasti havaitsemisen tehokkuutta.Yhtenäisten näytteenotto- ja havaitsemismenetelmien avulla UCOM-tunnistus tuottaa vakaat ja helposti tulkittavat tulokset, jotka sopivat paremmin seulontaprotokollaan, joka vaatii vähemmän ammattitaitoista henkilöstöä ja lääketieteellisiä resursseja.
Helppo havaita
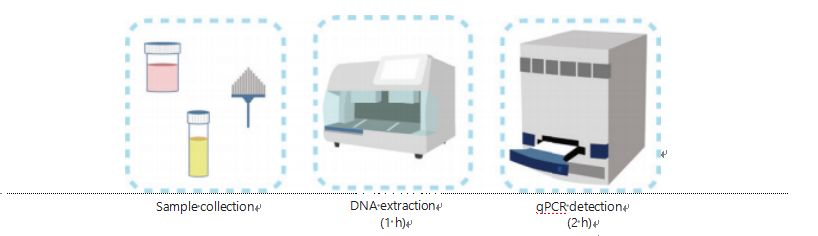
Nykyiset menetelmät DNA:n metylaation havaitsemiseen ovat monimutkaisia ja aikaa vieviä.Useimmat menetelmät vaativat bisulfiittimuunnoksen, mikä aiheuttaa näytteen laadun heikkenemistä ja mahdollisesti tuottaa epävakaita ja epätarkkoja tuloksia.Bisulfiittihoidon aiheuttama huono toistettavuus saattaa johtaa lääkäreiden ja potilaiden hämmennykseen ja häiritä edelleen seuranta- ja/tai hoitostrategioita.Siksi muutimme edelleen UCOM-tunnistusmenetelmää välttääksemme näytteiden ongelmallisen bisulfiittikäsittelyn, vastataksemme kliinisen sovelluksen vaatimuksiin ja parantaaksemme saavutettavuutta.Kehitimme uuden menetelmän käyttämällä metylaatioherkkiä restriktioentsyymejä yhdistettynä reaaliaikaiseen fluoresoivaan kvantitatiiviseen PCR:ään (Me-qPCR) UCOM:ien metylaatiostatuksen kvantifiointiin 3 tunnin sisällä helppojen käsittelymenetelmien avulla (kuva 3).Me-qPCR voi sisältää useita näytetyyppejä, kuten kehon nesteiden kliinistä keräystä ja itse kerättyjä virtsanäytteitä.Kerätyt kliiniset näytteet voidaan käsitellä, varastoida ja edetä helposti havaitsemiseen käyttämällä standardoitua ja automatisoitua DNA-uuttoa.Uutettu DNA voidaan sitten levittää suoraan Me-qPCR-alustalle yhden astian reaktiota ja tulosten kvantifiointituloksia varten.Yksinkertaisen tulosanalyysin jälkeen käyttämällä diagnostisia malleja, jotka on sovitettu ja validoitu tiettyihin syöpätyyppeihin, UCOM-tunnistustulosten lopullinen määritys tulkitaan ja esitetään puolikvantitatiivisena arvona.Me-qPCR-alusta ylittää perinteisen bisulfiittipyrosekvensoinnin UCOM-tunnistuksessa ja säästää 3 tuntia bisulfiittikonversiota EZ DNA Methylation-Gold Kit -protokollan mukaisesti.Innovatiivinen metylaation havaitsemisalusta tekee UCOM-tunnistuksesta vakaampaa, tarkempaa ja helpompaa30.
Kuva 3 UCOM:ien tunnistusprosessi.Näytetyyppejä ovat ammattimaisesti otettu BALF, Pap-harja ja/tai itse kerätty virtsa.DNA-uuttoprosessi voidaan sovittaa automaattiseen uuttolaitteeseen, jonka tuote voidaan havaita suoraan qPCR:llä.
UCOM:ien soveltaminen
Keuhkosyöpä
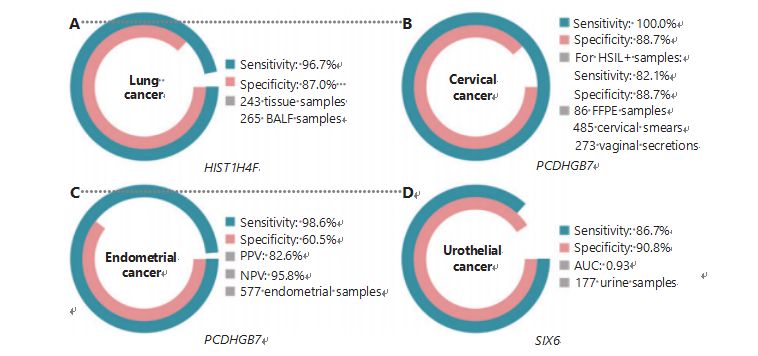
Keuhkosyöpä on maailman toiseksi yleisimmin diagnosoitu ja tappavin syöpä, ja sen osuus uusista tapauksista on 11,4 prosenttia ja uusista kuolemista 18,0 prosenttia1.Kaikista diagnooseista 85 % on ei-pienisoluista keuhkosyöpää (NSCLC) ja 15 % pienisoluista keuhkosyöpää (SCLC), jolla on korkeampi pahanlaatuisuus38.Pieniannoksinen tietokonetomografia (LDCT) on tällä hetkellä suositeltu keuhkosyövän seulontamenetelmä, ja sen on osoitettu parantavan varhaista havaitsemista ja vähentävän kuolleisuutta6;Kuitenkin alhaisen spesifisyyden ja huonon saavutettavuuden vuoksi LDCT ei ole vielä toiminut tyydyttävänä seulontamenetelmänä, kuten myös muut yleiset syöpämarkkerit, kuten CEA39.LDCT-seulontastrategian kustannukset ja mahdollisuudet jäädä diagnoosit ja virhediagnoosit estävät keuhkosyövän seulonnan edistämisen etenemistä40.HIST1H4F, UCOM, on valtava potentiaali varhaisen havaitsemisen biomarkkerina bronkoalveolaarisen nesteen (BALF) näytteissä27.HIST1H4F on hypermetyloitunut keuhkojen adenokarsinoomassa ja keuhkojen levyepiteelikarsinoomassa, havaitsemisspesifisyys on 96,7 % ja herkkyys 87,0 % (kuva 4A) ja poikkeuksellinen suorituskyky I vaiheen syövissä27.HIST1H4F:n spesifisyys on 96,5 % ja herkkyys 85,4 % NSCLC:lle ja 96,5 % ja 95,7 % SCLC27:lle.Lisäksi näytteet kahdeksasta muusta syöpätyypistä, mukaan lukien haima- ja paksusuolensyövät, ovat vahvistaneet, että HIST1H4F on hypermetyloitunut kaikissa kahdeksassa tyypissä27.
Kohdunkaulansyöpä
Kohdunkaulansyöpä oli neljänneksi yleisimmin diagnosoitu syöpä ja neljänneksi yleisin naisten syöpäkuolemien syy vuonna 2020, ja sen osuus uusista tapauksista oli 3,1 prosenttia ja syöpäkuolemien määrä maailmanlaajuisesti 3,4 prosenttia1.Kohdunkaulan syövän eliminoimiseksi vuoteen 2030 mennessä WHO:n ehdotuksen mukaisesti kohdunkaulansyövän varhainen havaitseminen on välttämätöntä.Jos se havaitaan varhaisessa vaiheessa, viiden vuoden eloonjäämisaste saavuttaa 92 % invasiivisessa kohdunkaulan syövässä41.American Cancer Societyn (ACS) ohjeissa ehdotetaan kohdunkaulan sytologisia testejä, primaarisia HPV-testejä tai seulontatestejä42.Kohdunkaulan sytologia on invasiivinen ja pystyy havaitsemaan vain 63,5 % CIN2+ -tapauksista37.
PCDHGB7 sen sijaan on toiminut paljon paremmin käyttämällä Papa-kokeita ja emättimen eritteitä, ja se voi tehokkaasti erottaa HSIL:n LSIL:stä erittäin varhaisessa vaiheessa.Pelkästään PCDHGB7:n herkkyys on 100,0 % ja spesifisyys 88,7 % kohdunkaulan syövän suhteen (kuvio 4B) ja 82,1 % herkkyys ja 88,7 % spesifisyys HSIL+-näytteille30.PCDHGB7:llä on myös 90,9 % herkkyys ja 90,4 % spesifisyys kohdunkaulan syövän emättimen eritenäytteissä, jotka on paljon helpompi kerätä30.Yhdistettynä korkean riskin (hr)HPV-testiin tai Thinprep Cytology Testiin (TCT) PCDHGB7:n herkkyys kasvaa 95,7 % ja spesifisyys 96,2 %, mikä ylittää merkittävästi hrHPV-testin (20,3 %), TCT:n (51,2 %). ) ja nämä kaksi yhteensä (57,8 %) kohdunkaulan syövän osalta30.PCDHGB7:n on myös osoitettu hypermetyloituneen 17 syöpätyypissä TCGA-tietokannasta, mikä osoittaa sen sopivuuden UCOM-perheeseen30.
Kuva 4 UCOM:t on validoitu neljässä syöpätyypissä laajamittaisissa kliinisissä tutkimuksissa.A. UCOM:n HIST1H4F:n suorituskyky keuhkosyövän havaitsemisessa 508 näytteestä.B. UCOM:n PCDHGB7:n suorituskyky kohdunkaulan syövän havaitsemisessa 844 näytteestä.C. PCDHGB7:n, UCOM:n, suorituskyky kohdun limakalvon syövän havaitsemisessa 577 kohdun limakalvon Pap- ja Tao-harjanäytteestä.D. SIX6:n, UCOM:n, suorituskyky uroteelisyövän havaitsemisessa 177 näytteestä.
EC
EC on yksi yleisimmistä naisten lisääntymisjärjestelmän syövistä maailmanlaajuisesti: arviolta 4,2 miljoonaa uutta tapausta ja 1 % syöpään liittyvistä kuolemista vuosittain1.Onnistuneella diagnoosilla varhaisessa vaiheessa EC on parannettavissa ja sen viiden vuoden eloonjäämisaste on 95 % vaiheen I syövässä.Potilaat, joilla on oireita, kuten epänormaalia kohdun verenvuotoa, saavat määräajoin kliinisen arvioinnin ja niille tehdään invasiivisia ja kivuliaita biopsiatoimenpiteitä, vaikka vain 5–10 %:lle kehittyy lopulta EC43.Transvaginaalinen ultraääni, joka on yleinen tunnistusmenetelmä, on erittäin epäluotettava, koska se ei pysty erottamaan hyvänlaatuisia pahanlaatuisia endometriumin muutoksia ja koska se on korkea väärien positiivisten tulosten määrä44.
Seerumin CA-125, laajalti käyttöön otettu EC-biomarkkeri, ja PCDHGB7:n rinnakkaisvertailu suoritettiin.Seerumin CA-125:n herkkyys oli 24,8 %, mikä viittaa siihen, että CA-125 on riittämätön markkeri EC:lle huolimatta spesifisyydestä 92,3 %31.PCDHGB7-tunnistus käyttäen Pap-sivellinäytteitä antoi 80,65 %:n herkkyyden ja 82,81 %:n spesifisyyden ECatall-vaiheille, kun taas Tao-harjan herkkyys oli 61,29 % ja spesifisyys 95,31 %31.PCDHGB7-diagnostiikkamalli, joka perustuu Me-qPCR:ään, antoi 98,61 prosentin herkkyyden, 60,5 prosentin spesifisyyden ja 85,5 prosentin kokonaistarkkuuden käyttämällä Pap- ja Tao-harjanäytteitä (kuva 4C)31.
Uroteelin syöpä
Virtsarakon, munuaisaltaan ja virtsaputken syövistä koostuva virtsarakon syöpä oli vuonna 2020 seitsemänneksi yleisin syöpä maailmanlaajuisesti ja aiheutti 5,2 % uusista tapauksista ja 3,9 % kuolemista1.Uroteelisyövät, joista yli 50 % on virtsarakon syöpää, olivat neljänneksi yleisimmin diagnosoitu syöpä Yhdysvalloissa vuonna 2022, ja niiden osuus äskettäin diagnosoiduista tapauksista oli 11,6 %3.Noin 75 % virtsarakon syövistä luokitellaan ei-lihakseen invasiivisiksi virtsarakon syöpiksi, jotka rajoittuvat limakalvoon tai limakalvon alle45.Kystoskopiabiopsia on kultainen standardi uroteelisyövän diagnosoinnissa, joka toteutetaan fluoresenssi in situ -hybridisaatiolla (FISH) ja sytologisilla testeillä.FISH-tutkimuksella ja sytologialla on huono diagnostinen suorituskyky, ja kystoskopia on tunkeilevaa ja sillä on taustalla riski puuttua mikroleesiot, tulkita vaurioita väärin ja mahdollisesti aiheuttaa syövän leviämistä tai uusiutumista46.Aiemmin validoidun UCOM:n, PCDHGB7:n, osoitettiin myös hypermetyloituneen uroteelisyövässä käyrän alapuolella olevan pinta-alan ollessa 0,86, mikä viittaa mahdolliseen diagnostiseen kykyyn30.Jotta voitaisiin edelleen validoida useampia UCOM:ita ja ottaa paremmin huomioon useampia näytetyyppejä, SIX6, uusi UCOM, tutkittiin ja osoitti erinomaisen diagnostisen potentiaalin uroteelisyövän varhaisessa havaitsemisessa käyttämällä virtsanäytteitä Me-qPCR-alustalla.Virtsanäytteitä käyttävä SIX6-detektio osoitti 86,7 %:n kilpailevan herkkyyden ja 90,8 %:n spesifisyyden (kuva 4D), vaikka se oli ei-invasiivinen ja helppo hankkia32.SIX6:n potentiaalia etäpesäkkeiden seurannassa ja hoidon tehokkuuden arvioinnissa tutkitaan parhaillaan.
Tulevaisuus ja haasteet
UCOM:illa on vahva suorituskyky useiden syöpien diagnostiikassa, mutta työtä on vielä paljon jäljellä.Olemme laajentaneet UCOM-luetteloa ja validoineet aktiivisesti UCOM:ita useammissa syöpätyypeissä, mukaan lukien sellaisissa, joita on perinteisesti vaikea havaita.TCGA-tietokannoista saadut validointitulokset ovat entisestään vahvistaneet UCOM:iden käyttöä useammissa syöpätyypeissä ja useammissa tilanteissa.Alustavassa tutkimuksessa UCOM:illa on osoitettu olevan vahva diagnostinen potentiaali kolangiokarsinoomaan ja haiman adenokarsinoomaan, joita on lähes mahdotonta diagnosoida varhaisessa vaiheessa nykyisillä seulontamenetelmillä32,47.Kykyä havaita harvinaisia syöpiä UCOM:illa voidaan hyödyntää kiertävän kasvain-DNA:n (ctDNA) kanssa parannetulla nestebiopsia-alustalla48.Plasma-DNA-pohjaisella pan-syövän havaitsemispaneelilla tehdyssä tutkimuksessa herkkyys oli 57,9 %49.Korkeasta spesifisyydestä huolimatta kokonaissuorituskyky paljastaa, että parantamisen varaa on vielä.
UCOM:iden ainutlaatuiset ominaisuudet ovat tukeneet myös UCOM-potentiaalin tutkimista hoidon tehokkuuden arvioinnissa ja uusiutumisen seurannassa.RECIST:n (Response Evaluation Criteria in Solid Tumors) mukaan lääketieteellinen kuvantaminen on suositeltu menetelmä uusiutumisen seurantaan ja hoidon tehokkuuden arviointiin, kun taas kasvainmarkkereita käytetään yksinään arvioinnissa50.Todellisuudessa kuvantamismenetelmiin vaikuttavat kuitenkin suuresti taajuus ja ajoitus, ja siksi ne altistavat potilaat suuremmille riskeille ja kustannuksille51,52.SIX6 on validoitu toimimaan rintasyövän etäpesäkkeiden ennustajana32.Nestebiopsiaan perustuva ctDNA-seuranta mahdollistaa reaaliaikaisen seurannan minimaalisen taudin jäännöskuukausien ajan ennen radiologista havaitsemista, mikä ihanteellisesti viivästyttää ja ehkäisee uusiutumiseen liittyvää syövän etenemistä53.Alustavat tulokset viittaavat siihen, että UCOM:t heijastavat syövän hypermetylaation tasoa reaaliajassa välittömästi leikkauksen ja hoidon jälkeen32.UCOM:iden korkea herkkyys ja sovellettavuus useisiin ei-tunkeutuviin näytetyyppeihin mahdollistavat sen, että UCOM:t voivat toimia tarkana toistumisen seurantaa valvovana biomarkkerina säilyttäen samalla potilaan korkean hoitomyöntyvyyden.
Samaan aikaan testin julkinen saatavuus on toinen iso asia, joka vaatii lisäponnistuksia.Vaikka UCOM-tunnistusyhteistyötä on otettu käyttöön useammissa sairaaloissa toivoen, että siitä olisi hyötyä useammalle potilaille, Kiinan maaseudulla on suoritettu aktiivisesti pro bono -havaintoja ja -seulontoja.UCOM:t vaativat parempaa käytettävyyttä, jotta ne voidaan luokitella toteuttamiskelpoiseksi seulontatyökaluksi, erityisesti alikehittyneillä alueilla.
Vaikka UCOM-sovelluksen tulokset varhaisessa havaitsemisessa ovat lupaavia, UCOM:sta on olemassa monia tuntemattomia.Aktiivisen tutkimisen myötä tarvitaan lisätutkimuksia siitä, miksi UCOM:ita esiintyy yleisesti syövissä.UCOM:iden taustalla olevat epigeneettiset säätelymekanismit ovat lisätutkimuksen arvoisia, mikä voisi oikeuttaa uuden suunnan syövän hoitoon.Palatakseni kasvainten homogeenisuuden ja heterogeenisyyden väliseen vuorovaikutukseen, olemme kiinnostuneita siitä, miksi UCOM:t voivat olla poikkeus suurimmasta osasta syövän biomarkkereista, jotka liittyvät tiiviisti tiettyihin syöpätyyppeihin.UCOM-tunnistettujen DNA-metylaatiopoikkeamien roolia tuumorigeneesissä, kasvaimen etenemisessä ja etäpesäkkeissä ei ole määritetty soluidentiteetin menettämis- ja palautusprosessissa, ja se vaatii perusteellisen tarkastuksen.Toinen tärkeä kiinnostuksen kohteena on UCOM:iden homogeenisuusominaisuuden sisällyttäminen kudoskohtaisiin markkereihin toivossa, että syöpäjälkien tarkkaa havaitsemista ja kasvainkudoksen alkuperän tunnistamista voidaan lähestyä käänteisellä tavalla.UCOM:t voivat olla ihanteellinen työkalu syövän ehkäisyyn, syövän havaitsemiseen ja mahdollisesti syövän puolustamiseen ja poistamiseen.
Myönnä tukea
Tätä työtä tukivat Kiinan kansallinen tutkimus- ja kehitysohjelma (apuraha nro 2022BEG01003), Kiinan kansallinen luonnontieteellinen säätiö (apurahanumerot 32270645 ja 32000505), Heilongjiangin maakunnan terveyskomission apuraha (apuraha nro 2020-111) , ja Heze Science and Technology Instituten apuraha (apuraha nro 2021KJPT07).
Eturistiriitailmoitus
Wei Li on Shanghai Epiprobe Biotechnology Co., Ltd:n tutkimus- ja kehitysjohtaja. Wenqiang Yu toimii Epiproben tieteellisessä neuvottelukunnassa.W. Yu ja Epiprobe ovat hyväksyneet tähän työhön liittyvät vireillä olevat patentit.Kaikki muut kirjoittajat eivät ole ilmoittaneet kilpailevia etuja.
Tekijän panokset
Suunnitteli ja suunnitteli projektin: Chengchen Qian ja Wenqiang Yu.
Kirjoitti paperin: Chengchen Qian.
Teki kuvat: Chengchen Qian.
Arvosteli ja muokkasi käsikirjoituksen: Xiaolong Zou, Wei Li, Yinshan Li ja Wenqiang Yu.
Viitteet
1. Sung H, Ferlay J, Siegel RL, Laversanne M, Soerjomataram I, Jemal A, et ai.Globaalit syöpätilastot 2020: GLOBOCANin arviot
ilmaantuvuus ja kuolleisuus maailmanlaajuisesti 36 syövän osalta 185 maassa.CA Cancer J Clin.2021;71: 209-49.
2. Xia C, Dong X, Li H, Cao M, Sun D, He S, et ai.Syöpätilastot Kiinassa ja Yhdysvalloissa, 2022: profiilit, trendit ja tekijät.Chin MedJ (englanti).2022;135: 584-90.
3. Siegel RL, Miller KD, WagleNS, JemalA.Syöpätilastot, 2023. CA Cancer J Clin.2023;73: 17-48.
4. Crosby D, BhatiaS, Brindle KM, Coussens LM, Dive C, Emberton M, et ai.Syövän varhainen havaitseminen.Tiede.2022;375: eaay9040.
5. Ladabaum U, Dominitz JA, KahiC, Schoen RE.Strategiat varten
paksusuolen syövän seulonta.Gastroenterologia.2020;158: 418-32.
6. Tanoue LT, Tanner NT, Gould MK, Silvestri GA.Keuhkosyövän seulonta.Am J Respir Crit Care Med.2015;191: 19-33.
7. Bouvard V, WentzensenN, Mackie A, Berkhof J, BrothertonJ, Giorgi-Rossi P, et ai.IARC:n näkökulma kohdunkaulan syövän seulomiseen.N EnglJ Med.2021;385: 1908-18.
8. Xue P, Ng MTA, QiaoY.Kolposkopian haasteet kohdunkaulan syövän seulonnassa LMIC:issä ja tekoälyn ratkaisut.BMC Med.2020;18: 169.
9. Johnson P, Zhou Q, Dao DY, Lo YMD.Kiertyvät biomarkkerit hepatosellulaarisen karsinooman diagnosoinnissa ja hoidossa.Nat Rev Gastroenterol Hepatol.2022;19: 670-81.
10. Van PoppelH, Albreht T, Basu P, HogenhoutR, CollenS, Roobol M. Seerumin PSA-pohjainen eturauhassyövän varhainen havaitseminen Euroopassa ja maailmanlaajuisesti: menneisyys, nykyisyys ja tulevaisuus.Nat Rev Urol.2022;19:
562-72.
11. HolyoakeA, O'Sullivan P, Pollock R, Best T, Watanabe J, KajitaY,
et ai.Multipleksisen RNA-virtsatestin kehittäminen virtsarakon siirtymävaiheen solusyövän havaitsemiseen ja kerrostumiseen.Clin Cancer Res.2008;14: 742-9.
12. Feinberg AP, Vogelstein B. Hypometylaatio erottaa joidenkin ihmisen syöpien geenit normaaleista vastineistaan.Luonto.1983;301: 89-92.
13. Ng JM, Yu J. Promoter hypermetylaatio kasvain suppressori geenit mahdollisina biomarkkereina paksusuolen syövän.IntJ Mol Sei.2015;16: 2472-96.
14. Esteller M. Syövän epigenomiikka: DNA-metylomit ja histonimuunnoskartat.Nat Rev Genet.2007;8: 286-98.
15. Nishiyama A, Nakanishi M. Navigointi syövän DNA-metylaatiomaisemassa.Trends Genet.2021;37: 1012-27.
16. Xie W, Schultz MD, ListerR, Hou Z, Rajagopal N, Ray P, et ai.Ihmisalkion kantasolujen monilinjaisen erilaistumisen epigenominen analyysi.Cell.2013;153: 1134-48.
17. Li Y, Zheng H, Wang Q, Zhou C, WeiL, Liu X, et ai.Genominlaajuiset analyysit paljastavat Polycombin roolin DNA-metylaatiolaaksojen hypometylaation edistämisessä.Genome Biol.2018;19:18.
18. Koch A, JoostenSC, Feng Z, de Ruijter TC, DrahtMX, MelotteV,
et ai.DNA-metylaation analyysi syövässä: paikka tarkistettu.Nat Rev Clin Oncol.2018;15: 459-66.
19. KleinEA, Richards D, Cohn A, TummalaM, Lapham R, Cosgrove D, et ai.Kohdennettu metylaatioon perustuva usean syövän varhaisen havaitsemisen testin kliininen validointi riippumaton validointisarja.Ann Oncol.2021;32: 1167-77.
20. Hanahan D, Weinberg RA.Syövän tunnusmerkit.Cell.2000;100: 57-70.
21. Hanahan D. Syövän tunnusmerkit: uudet ulottuvuudet.Cancer Discov.2022;12: 31-46.
22. Schwartzberg L, Kim ES, Liu D, Schrag D. Tarkkuusonkologia: kuka, miten, mitä, milloin ja milloin ei?Am Soc Clin Oncol Koulutuskirja.2017: 160-9.
23. Liu H, Meng X, Wang J. Realtime quantitative methylation
PAX1-geenin havaitseminen kohdunkaulan syövän seulonnassa.IntJ Gynecol Cancer.2020;30: 1488-92.
24. Imperiale TF, RansohoffDF, Itzkowitz SH, Levin TR, Lavin P, Lidgard GP, et ai.Monikohde-DNA-testaus paksusuolen ja peräsuolen syövän seulontaan.N EnglJ Med.2014;370: 1287-97.
25. Li J, Li Y, Li W, Luo H, Xi Y, Dong S, et ai.Ohjauspaikannus
sekvensointi tunnistaa poikkeavia DNA-metylaatiomalleja, jotka muuttavat solujen identiteettiä ja kasvain-immuunivalvontaverkostoja.Perimä
Res.2019;29: 270-80.
26. Gao Q, LinYP, Li BS, Wang GQ, Dong LQ, Shen BY, et ai.Monien syöpien esteetön havaitseminen kiertävän soluttoman DNA-metylaatiosekvensoinnin avulla (THUNDER): kehitys- ja riippumattomat validointitutkimukset.Ann Oncol.2023;34: 486-95.
27. Dong S, Li W, Wang L, Hu J, Song Y, Zhang B, et ai.Histoniin liittyvät geenit hypermetyloituvat keuhkosyövässä ja hypermetyloituvat
HIST1H4F voisi toimia pan-syövän biomarkkerina.Cancer Res.2019;79: 6101-12.
28. HeijnsdijkEA, Wever EM, AuvinenA, Hugosson J, Ciatto S, Nelen V, et ai.Eturauhasspesifisen antigeeniseulonnan vaikutukset elämänlaatuun.N EnglJ Med.2012;367: 595-605.
29. LuzakA, Schnell-Inderst P, Bühn S, Mayer-Zitarosa A, Siebert U. Syövän seulonnan biomarkkeritestien kliininen tehokkuus itse maksavana terveyspalveluna: systemaattinen katsaus.Eur J Kansanterveys.2016;26: 498-505.
30. Dong S, Lu Q, Xu P, Chen L, Duan X, Mao Z, et ai.
Hypermetyloitu PCDHGB7 yleisenä ainoana syövän merkkiaineena ja sen käyttö kohdunkaulan syövän varhaisessa seulonnassa.Clin Transl Med.2021;11: e457.
31. Yuan J, Mao Z, Lu Q, Xu P, Wang C, Xu X, et ai.Hypermetyloitu PCDHGB7 biomarkkerina kohdun limakalvosyövän varhaiseen havaitsemiseen kohdun limakalvon harjanäytteistä ja kohdunkaulan raapimista.Edessä Mol Biosci.2022;8: 774215.
32. Dong S, Yang Z, Xu P, Zheng W, Zhang B, Fu F, et ai.Molemminpuolisesti
ainutlaatuinen epigeneettinen modifikaatio SIX6:ssa hypermetylaatiolla esisyöpävaiheen ja etäpesäkkeiden ilmaantumisen jäljittämiseksi.Signal Transduct Target Ther.2022;7: 208.
33. Huang L, Guo Z, Wang F, Fu L. KRAS-mutaatio: huumekäyttöön soveltuvasta syövän hoidossa.Signal Transduct Target Ther.2021;6: 386.
34. Belinsky SA, Nikula KJ, PalmisanoWA, MichelsR, SaccomannoG, GabrielsonE, et ai.P16:n (INK4a) poikkeava metylaatio on keuhkosyövän varhainen tapahtuma ja mahdollinen biomarkkeri varhaisessa diagnosoinnissa.Proc Natl Acad Sci U SA.1998;95: 11891-6.
35. Robertson KD.DNA:n metylaatio ja ihmisen sairaudet.Nat Rev Genet.2005;6: 597-610.
36. WentzensenN, Walker JL, Gold MA, Smith KM, ZunaRE,
Mathews C, et ai.Useita biopsioita ja kohdunkaulan syövän esiasteiden havaitseminen kolposkopiassa.J Clin Oncol.2015;33: 83-9.
37. De Strooper LM, Meijer CJ, Berkhof J, Hesselink AT, Snijders
PJ, Steenbergen RD, et ai.FAM19A4:n metylaatioanalyysi
kohdunkaulan naarmuissa oleva geeni on erittäin tehokas kohdunkaulan havaitsemisessa
karsinoomat ja pitkälle edenneet CIN2/3-leesiot.Cancer Prev Res (Phila).2014;7: 1251-7.
38. Thai AA, Solomon BJ, Sequist LV, Gainor JF, Heist RS.Keuhkosyöpä.Lansetti.2021;398: 535-54.
39. Grunnet M, Sorensen JB.Karsinoembryoninen antigeeni (CEA) kasvainmarkkerina keuhkosyövässä.Keuhkosyöpä.2012;76: 138-43.
40. Wood DE, KazerooniEA, Baum SL, EapenGA, EttingerDS, Hou L, et ai.Lung Cancer Screening, versio 3.2018, NCCN Clinical Practice Guidelines in Oncology.J Natl Compr Canc Netw.2018;16: 412-41.
41. American Cancer Society.Syöpätietoa ja lukuja.Atlanta, GA, USA: American Cancer Society;2023 [päivitetty 1. maaliskuuta 2023;lainattu 2023, 22. elokuuta].
42. FonthamETH, Wolf AMD, Church TR, EtzioniR, Flowers CR,
Herzig A, et ai.Kohdunkaulan syövän seulonta keskimääräiseen riskiin kuuluville: 2020 ohjepäivitys American Cancer Societylta.CA Cancer J Clin.2020;70: 321-46.
43. Clarke MA, Long BJ, Del Mar MorilloA, Arbyn M, Bakkum-Gamez JN, Wentzensen N. Endometriumin syöpäriskin ja postmenopausaalisen verenvuodon yhteys naisilla: systemaattinen katsaus ja meta-analyysi.JAMA Intern Med.2018;178: 1210-22.
44. Jacobs I, Gentry-MaharajA, Burnell M, ManchandaR, Singh N,
Sharma A, et ai.Transvaginaalisen ultraäänitutkimuksen herkkyys
postmenopausaalisten naisten kohdun limakalvosyövän osalta: tapauskontrollitutkimus UKCTOCS-kohortissa.Lancet Oncol.2011;12: 38-48.
45. BabjukM, Burger M, CompératEM, Gontero P, MostafidAH,
PalouJ et ai.European Association of Urology Guidelines on ei-lihakseen invasiivista virtsarakon syöpää (TaT1 ja Carcinoma In Situ) -
2019 päivitys.euroa Urol.2019;76: 639-57.
46. Aragon-Ching JB.Haasteet ja edistysaskeleet uroteelin yläkanavan ja virtsarakon karsinooman diagnosoinnissa, biologiassa ja hoidossa.Urol Oncol.2017;35: 462-4.
47. Rizvi S, KhanSA, Hallemeier CL, Kelley RK, Gores GJ.
Kolangiokarsinooma – kehittyvät käsitteet ja terapeuttiset strategiat.Nat Rev Clin Oncol.2018;15: 95-111.
48. Ye Q, Ling S, Zheng S, Xu X. Nestebiopsia hepatosellulaarisessa
karsinooma: kiertävät kasvainsolut ja kiertävä kasvain-DNA.Mol Syöpä.2019;18: 114.
49. Zhang Y, Yao Y, Xu Y, Li L, Gong Y, Zhang K, et ai.Pan-syöpä
kiertävän kasvaimen DNA:n havaitseminen yli 10 000 kiinalaispotilaalla.Nat Commun.2021;12:11.
50. Eisenhauer EA, Therasse P, BogaertsJ, Schwartz LH, Sargent D, Ford R, et ai.Uudet vasteen arviointikriteerit kiinteissä kasvaimissa: tarkistettu RECIST-ohje (versio 1.1).Eur J Syöpä.2009;45: 228-47.
51. LitièreS, Collette S, de Vries EG, Seymour L, BogaertsJ.RECIST - oppia menneestä rakentaaksesi tulevaisuutta.Nat Rev Clin Oncol.
2017;14: 187-92.
52. Seymour L, BogaertsJ, Perrone A, FordR, Schwartz LH, Mandrekar S, et ai.iRECIST: ohjeet kokeissa käytettäväksi vastekriteereistä
immunoterapeuttisten aineiden testaus.Lancet Oncol.2017;18: e143-52.
53. PantelK, Alix-Panabières C. Nestebiopsia ja minimaalinen jäännössairaus – viimeisimmät edistysaskeleet ja vaikutukset parantumiseen.Nat Rev Clin Oncol.2019;16: 409-24.
Lainaa tätä artikkelia seuraavasti: Qian C, Zou X, Li W, Li Y, Yu W. Syövän vastainen etuvartio: universaalit vain syövän merkkiaineet.Cancer Biol Med.2023;20: 806-815.
doi: 10.20892/j.issn.2095-3941.2023.0313
Postitusaika: 7.5.2024